関連記事
早大ら、次世代型光ガン治療法を開発 担がんモデルマウスで腫瘍を消失
早大と防衛医大は17日、生体組織表面にシールのように貼り付けられる体内埋め込み型の発光デバイスを開発。このデバイスを担がんモデルマウスの体内に移植することで、光がん治療に応用し、腫瘍を消失させることに成功したと発表した。
【こちらも】がんと遺伝子などの関連を解析 生物ビッグデータ活用基盤の構築へ
光線力学療法(Photodynamic therapy: PDT)は、光増感剤が集まった病巣へ光を照射することにより発生する活性酸素で、がんの細胞死を誘導する技術だ。1990年に保険承認され、病変選択的ながん治療法として知られる。2000年に入ってから、従来の1/1000という出力の非常に弱い光源を用いた「メトロノミックPDT (mPDT)」法を提唱。従来のPDT法では難しかった体内深部の臓器にできたがんを治療できる新たな医療技術として大いに期待される。
mPDT法の課題は、光源と腫瘍との位置合わせだ。光強度の非常に弱いmPDTでは、光源の位置が少しでもずれると腫瘍への光照射が不十分となり、抗腫瘍効果が得られない。そのため、生体内の臓器や組織上で安定に固定でき、腫瘍に対して長時間安定的に光照射できる体内埋め込み型の発体内埋め込み型の発光デバイスの開発が望まれている。
一方、生体内の組織や臓器表面は、粘膜などの薄い膜に覆われていて滑りやすく、一般的に硬い電子素子を縫合術や医療用接着剤を使わず安定に固定することは困難と考えられていた。そこで、硬くドライな電子機器と柔らかくウェットな生体組織を滑らかにつなぐ材料として高分子ナノ薄膜に着目し、生体内の臓器や組織上に数ミリメートルサイズの小型デバイスを縫合なしに長期間安定に固定する手法の実現を目指した。
技術の詳細は、16日の英国科学誌「Nature Biomedical Engineering」のオンライン速報版で公開された。
●体内埋め込み型発光デバイスを用いたmPDTの特長
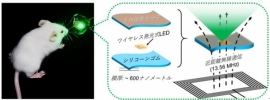
生体内の臓器や組織表面にシールのように貼り付けるだけで固定できる体内埋め込み型の発光デバイスを開発しmPDTへ応用。膜厚約600ナノメートルのシリコーンゴム製ナノ薄膜の表面に生体模倣型接着分子であるポリドーパミンを修飾。生体組織への接着性が約25倍向上し、生体内においても小型の電子デバイスを縫合なしに2週間以上安定に生体組織上で固定させた。
この伸縮性と接着性に優れたナノ薄膜を用いて近距離無線通信・発光式LEDチップを生体内の組織や臓器表面上で固定することで、mPDTが抱える光源の「ずれ」の問題を解決し、完全埋め込み型のmPDTシステムを構築した。
光源を腫瘍の間近に設置できるため、従来のPDTで用いられているレーザー光の1000分の1のLEDでも顕著な腫瘍縮退効果が得られる。加えて、近赤外光しか使われてこなかったPDTを埋め込み型デバイスにすることにより、緑色光でも治療効率の高いPDTを世界に先駆けて実現。実験では、緑色光を使用することで腫瘍を完全に消失させることにも成功した。
●次世代型光ガン治療(早大ら、体内埋め込み型発光デバイス)のテクノロジー
生活水準を維持しつつ治癒あるいは生存期間延長を可能とさせる低侵襲がん治療法である。体内埋め込み型の発光デバイスは、移植する際に縫合を必要としないため、脳や肝臓、膵臓のような重要な血管や神経を巻き込む組織、構造的に脆弱な組織にも適用が可能だ。
従来のPDTに比べて非常に弱い光で治療するmPDTでは、レーザー光照射にともなう副作用は原理上起こらない。無線給電式・埋め込み型光がん治療の臨床応用が実現すれば、患者の負担が少ない次世代型がん治療法となるであろう。(記事:小池豊・記事一覧を見る)
スポンサードリンク