関連記事
遺伝子改変マウスを高効率で作製 幅広い分野での応用に期待 理研
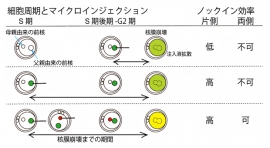
細胞周期とマイクロインジェクションの時期が、ノックイン効率に与えることを示した図(画像: 理化学研究所の発表より)[写真拡大]
理化学研究所の阿部高也技師らの研究チームが6月18日、ゲノム編集技術「クリスパー・キャス9」を使ったノックインマウスの作製法を開発したと発表した。特定のDNA配列を入れ替えるノックインマウスは、これまで作製効率の低さが指摘されてきたが、受精卵の前核にクリスパー・キャス9を挿入することで、標的とするDNA配列を相同組換えする確率を高めた。
【こちらも】理研、遺伝子情報の書き換えでマウスの病理改善に成功
今回の研究は「ノックインマウスの作製効率は非常に低い」という従来の課題を覆すことになり、基礎研究から応用研究まで幅広い分野への応用が期待される。
ノックインマウスは、特定のタンパク質を生成する遺伝子や、外来遺伝子をマウスの受精卵に注入して作成する。人間の病気に似た状態を再現したマウスを作り、病気の治療法開発を促す狙いがある。別名で、トランスジェニックマウスとも呼ぶ。1980年に世界で初めて作製が確認され、90年代以降、研究が加速した。
2000年代からは、胚性幹(ES)細胞を用いた従来の作製法に代わり、遺伝子の切り貼りを自在にできるゲノム編集技術が、マウスの遺伝子改変研究に導入され始めた。「ZFN」や「TALEN」の導入を経て、12年に登場した「クリスパー・キャス」が、利便性やコストの面から研究現場の主流に。国内研究では、理研が16年、クリスパー・キャス9を応用し、生体内の分裂していない細胞でも遺伝子挿入できるゲノム編集技術「HITI(ヒティ)」を開発している。
狙ったDNAを効率よく切断するクリスパー・キャスの台頭により、ノックインマウスの作製期間は、従来の1~2年から1~2カ月程度に縮まった。しかし、長い外来遺伝子のノックインマウスの作製確率は、ゲノム編集技術を使っても10%程度と低く、依然として課題が残存。
そんな中で、理研の研究チームは今回、クリスパー・キャス9を用い、効率性の高いノックインマウスの作製法確立に取り組むことにした。
実験研究では、ゲノム編集に必要なDNA切断酵素(キャス9)とガイドRNAを、マウスの受精卵の基になる母親由来の核と、父親由来の核に注入(マイクロインジェクション)するタイミングによって、ノックインマウスの作製確率が高まるかを探った。
受精から早い時期(S期)と遅い時期(S期後期とG2期)で比較検討した結果、DNA配列の相同組換えによる修復機構が活性化する後者のS期後期とG2期では、ノックインマウスが獲得できなかったのに対し、前者のS期は作製確率が70%と飛躍的に高まった。
さらに、母親、父親両方の核にマイクロインジェクションしたところ、作製確率は82%に上昇。ノックインした被験体の40%で、両方の染色体にノックインが発生していた。また、それぞれの核にGFP(緑色蛍光タンパク質)とRFP(赤色蛍光タンパク質)の遺伝子を注入すると、それぞれの染色体に異なる遺伝子をノックインすることに成功した。研究チームは「ノックインのイベントは、母親、父親両方の核が融合する核融合の発生前に起きている」とした。
加えて、研究チームは、S期後期からG2期のノックイン効率が下がった要因について、「核融合時は核膜が一時的でも崩壊するため、核に注入したキャス9とガイドRNAが細胞質に拡散したのではないか」と推測。外来遺伝子がゲノムに挿入されるためには、「数時間は核内に外来遺伝子が高濃度で存在することが重要で、結果的にはマイクロインジェクションの時期が成否を握る」と論じた。
本研究は、5月19日付のオンライン科学雑誌「Cell Reports」に掲載されている。(記事:小村海・記事一覧を見る)
スポンサードリンク
関連キーワード
スポンサードリンク
- 怒りを「紙に書き」「丸めて捨てる」と怒りが静まる 名大らが確認 4/13 08:51
- 量子もつれの情報伝達速度には限界があった 京大らの研究
 4/ 6 16:31
4/ 6 16:31 - 全身性強皮症に抗酸化サプリが有効な可能性 ルイ・パストゥール医学研究センター
 4/ 5 09:06
4/ 5 09:06 - DNAの切断を修復する仕組み解明 がんの原因解明・治療に期待 東大ら
 3/22 19:19
3/22 19:19 - 日本周辺海域の魚類が小型化 地球温暖化の影響 東大
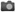 3/ 5 09:15
3/ 5 09:15
