FDA、世界最小の心臓ポンプImpella ECPを画期的医療機器に指定
配信日時: 2021-08-23 14:08:00

FDA、世界最小の心臓ポンプImpella ECPを画期的医療機器に指定
(米マサチューセッツ州ダンバース)-(ビジネスワイヤ) -- 米国食品医薬品局(FDA)は、アビオメッド(NASDAQ: ABMD)の拡張型経皮的心臓ポンプImpella ECPを画期的医療機器に指定しました。この指定は、FDAが設計反復、臨床試験プロトコル、市販前承認(PMA)の申請を含むImpella ECPの規制当局の審査プロセスを優先することを意味します。
本プレスリリースではマルチメディアを使用しています。リリースの全文はこちらをご覧ください。:https://www.businesswire.com/news/home/20210822005051/ja/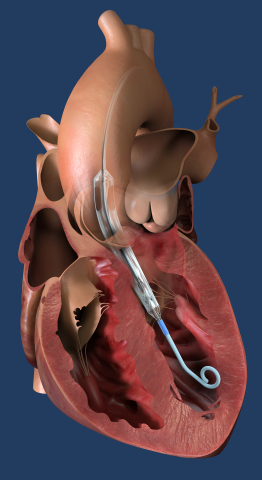 Impella ECPは世界最小の心臓ポンプで、左室へと経皮的に挿入され、拡張して心臓のポンプ機能を補助し、3.5 L/min以上の流量を提供。(写真:ビジネスワイヤ)
Impella ECPは世界最小の心臓ポンプで、左室へと経皮的に挿入され、拡張して心臓のポンプ機能を補助し、3.5 L/min以上の流量を提供。(写真:ビジネスワイヤ)
Impella ECPは世界最小の心臓ポンプで、挿入部の小口径アクセスおよび閉鎖術に対応した初めての製品です。体内への挿入および抜去に際しての直径は9Fr(3mm)です。心臓に留置されている間、心臓のポンプ機能を補助しながら他のImpellaのカニュラにあたる部分を拡張し血液を通すことで、3.5 L/min以上の流量が得られます。
FDAが画期的医療機器指定を与えた根拠の1つは、FDAの規制下で実施されたアーリーフィージビリティスタディの一環として、Impella ECPによる治療を最初に受けた患者21人から得た良好な臨床データです。FDAは本指定を与えるに当たり、Impella ECPがFDAの厳格な画期的医療機器要件を満たしていると判断しました。
アビオメッドの最高医療責任者(CMO)であるチャック・サイモントン医師は、次のように述べています。「今回の指定は、FDAがImpella技術の臨床での有効性をあらためて認めたものであり、Impella ECPの革新的な特徴を認識していることを意味しています。つまりImpella ECPは、小口径の血管アクセスにより、一層安全な使用を実現し、冠動脈血行再建術のための血行動態補助を必要としている患者さんにもっと利用していただける可能性を備えているのです。」
米国では、推定44万人の患者がハイリスクPCIの適応となっていながら、まだ十分な治療を受けていません。Impella ECPの小型サイズにより、より多くの医師が極めて重要な血行動態補助を、必要としている冠動脈疾患患者に提供できるようになります。
Impella ECPを使用した世界初の患者は、デトロイトに住む4人の子供と11人の孫がいる、自動車工場を退職したRobert Matthewsさん(80歳)です。Matthewsさんは20年以上にわたり心疾患を患い、複数回の手術に耐えてきました。彼は2020年に、Ascention St.John病院(デトロイト)のインターベンション心臓専門医で機械的循環補のディレクターであるのAmir Kaki医師に紹介されました。Kaki医師は複数の冠動脈閉塞と心機能低下を診断し、MatthewsさんがImpella補助下のProtected PCIに適した候補者であると判断いたしました。Kaki医師が冠動脈閉塞の再開通とステント留置に先立ちImpella ECP心臓ポンプを挿入しました。MatthewsさんはImpella ECPによる治療を受けた世界初の患者となりました。
Matthewsさんは2日後に帰宅して、家族や友人は彼が元気を取り戻したことにすぐ気づきました。Matthewsさんは現在、生活の質の回復をもたらした最先端技術に感謝しています。
注意: Impella ECPは治験用デバイスであり、連邦法により用途は治験での使用に限定されています。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術やバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国FDAの承認を取得しています。
Impella 2.5、Impella CP、SmartAssist®搭載Impella CP、Impella 5.0®、Impella LD®、SmartAssist®搭載Impella 5.5®は、心原性ショック状態にある心臓発作または心筋症患者の治療を目的に米国FDAの承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスと酸素化デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、呼吸不全の患者さんに十分な酸素を供給することで心筋の負担を軽減し、その回復を目指しています。詳細情報についてはwww.abiomed.comをご覧ください。
将来見通しに関する記述
将来見通しに関する記述はいずれも、アビオメッドが米国証券取引委員会に提出した定期報告書で記載されたものなど、リスクと不確実性の影響を受けます。実際の結果は予想された結果とは大きく異なる可能性があります。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
本プレスリリースは、米国アビオメッド・インクが現地時間2021年8月18日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
businesswire.comでソースバージョンを見る:https://www.businesswire.com/news/home/20210822005051/ja/
連絡先
For further information:
Tom Langford
Director of Communications
978-882-8408
tlangford@abiomed.com
プレスリリース情報提供元:ビジネスワイヤ
スポンサードリンク
「Abiomed」のプレスリリース
- アビオメッド、心不全患者の予後を改善する画期的な医療機器メーカーpreCARDIA社を買収06/03 23:02
- アビオメッド、ポーラ・A・ジョンソン医師を社外取締役に任命05/06 15:31
- アビオメッド、マイロン・ロール医師を取締役に任命02/19 11:06
- 「Abiomed」のプレスリリースをもっと読む
スポンサードリンク
最新のプレスリリース
- FDA、世界最小の心臓ポンプImpella ECPを画期的医療機器に指定08/23 14:08
- 日立、人事異動を発表08/23 14:00
- Indonesia's Mandalika Circuit: Racing to end the 26-year wait08/23 14:00
- グッドイヤー、フォルクスワーゲン 新型「Golf Variant(ゴルフ ヴァリアント)」に純正装着08/23 14:00
- KPMGコンサルティング、デジタル成熟度診断サービスを開始 ―企業内のDX推進状況を可視化し、DX推進計画立案の実行支援を提供―08/23 14:00
- 最新のプレスリリースをもっと見る

