明治大学農学部久城哲夫教授らの研究チームが、糸状菌の新規細胞膜成分「ステロール−アミノ酸誘導体」を新たに発見しました
配信日時: 2020-09-28 11:00:00

明治大学農学部農芸化学科ケミカルバイオロジー研究室の佐賀裕亮(助教)、立松俊祐(博士前期課程2年)、横川大祐(博士前期課程1年)、久城哲夫(教授)と微生物生態学研究室の中島春紫(教授)らの研究グループは、ストラスブール大学(フランス)、フロリダ中央大学(アメリカ)、パスツール研究所(フランス)との共同研究により、糸状菌においてエルゴステロールとアミノ酸が結合した新規ステロール脂質を発見し、その生合成と分解に関わる遺伝子を同定しました。本成果は、新たな抗真菌剤の開発へとつながる可能性が期待されます。
糸状菌のアミノアシルtRNA合成酵素の一種であるアスパルチルtRNA合成酵素(ErdS)には、他の生物には見られない糸状菌特異的なドメイン(DUF2156)が付加していた。ErdSはtRNA依存的にアスパラギン酸のエルゴステロールへの転移反応を触媒し、エルゴステリルアスパラギン酸(Erg-Asp)の生合成を行った。ゲノム上でErdS遺伝子の隣に存在したErdH遺伝子は、Erg-Aspの加水分解を担う酵素遺伝子であった。Erg-Aspの生合成と分解を担う酵素が糸状菌に広範に存在することから、Erg-Aspの内生量は調節されており、重要な生理機能を担っていることが示唆された。
要旨
アミノアシルtRNA合成酵素(aaRS)は、生物の基本となる遺伝暗号の翻訳過程において、tRNAと対応するアミノ酸を結合させる中心的な役割を担っています。全ての生物に共通に保存されている重要な酵素ですが、近年、aaRSに存在する生物種特異的なドメインを介して、様々な二次機能も有することが分かってきました。
明治大学農学部ケミカルバイオロジー研究室の佐賀裕亮(助教)、立松俊祐(博士前期課程2年)、横川大祐(博士前期課程1年)、久城哲夫(教授)と微生物生態学研究室の中島春紫(教授)らの研究グループは、ストラスブール大学(フランス)、フロリダ中央大学(アメリカ)、パスツール研究所(フランス)との共同研究により、糸状菌のaaRSの一種であるアスパルチルtRNA合成酵素に見出された糸状菌特異的なドメインが、tRNA依存的にエルゴステロールとアスパラギン酸の結合を触媒し、これまで発見されたことのない新規細胞膜脂質成分であるエルゴステリルアスバラギン酸(Erg-Asp)を生合成することを明らかにしました。
研究成果は、米国科学アカデミー紀要「Proceedings of the National Academy of Sciences of the USA(PNAS)」2020年6月30日号に掲載されました。
※研究グループ
明治大学 農学部農芸化学科ケミカルバイオロジー研究室
教授 久城 哲夫(くしろ てつお)
助教 佐賀 裕亮(さが ゆうすけ)
博士前期課程2年生 立松 俊祐(たてまつ しゅんすけ)
博士前期課程1年生 横川 大祐(よこかわ だいすけ)
微生物生態学研究室
教授 中島 春紫(なかじま はるし)
ストラスブール大学
教授 Hubert D. Becker
准教授 Frederic Fischer
CNRS研究員 Bruno Senger
博士研究員 Nassira Mahmoudi
大学院生 Nathaniel Yakobov
大学院生 Guillaume Grob
フロリダ中央大学
准教授 Herve Roy
大学院生 Christopher D. Grube
パスツール研究所
教授 Jean-Paul Latge
研究員 Isabelle Mouyna
1.背景
アミノアシルtRNA合成酵素(aaRS)は、生物の基本となる遺伝暗号の翻訳において中心的な役割を担い、タンパク質の合成に使われる20種類のアミノ酸と、対応するtRNAを結合させるアミノアシル化反応を触媒します。近年、これらaaRSに本来の機能とは異なる様々な第二の機能が存在することが明らかになり、ヒトにおいてはガンの抑制や栄養、免疫、炎症、血管新生、神経形成のシグナルに関与することなどが明らかとなっています。このようなaaRSの二次機能には、触媒活性に必要な保存されたドメインとは異なり、生物種特異的に存在する特徴的なドメインが多く関与しています。
糸状菌(カビ)のaaRSの一種であるアスパルチルtRNA合成酵素(AspRS)には、他の生物種には見られない糸状菌特異的な付加ドメイン(DUF2156)が存在しました(図1)。これまで、糸状菌のaaRSにおいて生物種特異的な付加ドメインが見出された例はなく、その機能も不明でした。
2.研究内容と成果
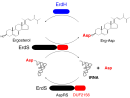
本研究グループは、味噌や日本酒の醸造に用いられる麹菌(Aspergillus oryzae)において、AspRSに見られた機能未知ドメインDUF2156の機能解析を行ったところ、真菌に存在する細胞膜の脂質成分であるエルゴステロールに、アスパラギン酸が結合した新規化合物エルゴステリルアスバラギン酸(Erg-Asp)の生合成を行っていることが判明しました(図2)。このとき、tRNAに結合したアスパラギン酸がDUF2156の作用によりエルゴステロールに転移することが明らかになりました(図3)。Erg-Aspのようにステロールにアミノ酸が結合した物質はこれまでに単離されたことはなく、初めての発見であります。DUF2156を含むAspRSは、Erg-Asp合成酵素(ErdS)と命名されました。
さらに、ゲノム上でErdS遺伝子の隣に加水分解酵素と思われる遺伝子ErdHが存在しており、その機能解析を行ったところ、Erg-Aspの加水分解を触媒し、エルゴステロールを生成することが分かりました(図3)。このようにErg-Aspの生合成と分解を行う酵素が糸状菌に広く存在していることは、Erg-Aspが何らかの重要な生理機能を持っていることを強く示唆しています。
3.今後の期待
本研究グループは、aaRSに結合した機能未知ドメインの機能解析を通して、世界で初めてErg-Aspのようなステロールにアミノ酸が結合した化合物を発見しました。tRNAを介した脂質成分のアミノ酸による修飾は、真核生物では初めての知見です。また、Erg-Aspの生合成と分解を行う特異的な酵素が存在することから、Erg-Aspの内生量が調節されていることが考えられます。Erg-Aspは全エルゴステロールの10%程度含まれていたことから、細胞膜を介した情報伝達や輸送に関わることが考えられました。今後は、Erg-Aspの生理機能の解明が待たれますが、本研究を端緒として、ステロールにアミノ酸が結合した新規脂質成分が、糸状菌だけでなく広範な生物種においても存在し、重要な機能を有している可能性が考えられます。
本化合物の作用機構を明らかにすることで、抗真菌剤の開発など今後のさらなる研究が期待されます。
4.論文情報
<タイトル>
RNA-dependent sterol aspartylation in fungi
<著者名>
Nathaniel Yakobov, Frederic Fischer, Nassira Mahmoudi, Yusuke Saga, Christopher D. Grube, Herve Roy, Bruno Senger, Guillaume Grob, Shunsuke Tatematsu, Daisuke Yokokawa, Isabelle Mouyna, Jean-Paul Latge, Harushi Nakajima, Tetsuo Kushiro, Hubert D. Becker
<雑誌>
Proceedings of the National Academy of Sciences of the USA (PNAS)
<DOI> https://doi.org/10.1073/pnas.2003266117
図1. 糸状菌のアスパルチルtRNA合成酵素(ErdS)にみられる糸状菌特異的ドメイン(DUF2156)
黒色のボックスは通常のtRNA合成酵素に相当するドメイン(AspRS)、赤色のボックスが糸状菌特異的なドメイン(DUF2156)を表しています。麹菌(Aspergillus oryzae)と赤パンカビ(Neurospora crassa)の例を示していますが、ErdSは糸状菌に幅広く存在しています。このドメインは、ヒト(Homo sapiens)、パン酵母(S. cerevisiae)、植物(Arabidopsis thaliana)、大腸菌(E. coli)には存在していません。
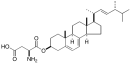
図2. 新規ステロール脂質エルゴステリルアスパラギン酸(Erg-Asp)の化学構造
エルゴステロールの水酸基にアスパラギン酸がエステル結合した化合物です。
図3. ErdSおよびErdHの機能
ErdSのAspRSドメイン(黒)によりtRNAとアスパラギン酸(Asp)が結合しAsp-tRNAを生成します。さらに、ErdSのDUF2156ドメイン(赤)によりAspがエルゴステロールに転移し、Erg-Aspが生成します。また、ErdH(青)はErg-Aspの加水分解を行います。
詳細はこちら
プレスリリース提供元:@Press
スポンサードリンク
「学校法人明治大学広報課」のプレスリリース
- Enjoy Meiji at Home!明大への留学を目指す外国人学生のためのオンラインイベント 6月~7月続々開催06/11 11:00
- 低学年限定海外インターンシップがアワード受賞06/08 16:30
- 根寄生植物の発芽を制御する新たな分子を発見06/04 12:30
- 「学校法人明治大学広報課」のプレスリリースをもっと読む
スポンサードリンク
最新のプレスリリース
- 地域のD2C支援事業「鳥取マーケット」がβ版から機能アップデートし、正式リリース。同時に掲載事業者の一般募集開始06/20 17:15
- 次世代趣味友達マッチングサービス「Room8(β版)」iOS版、Android版同時リリース!06/20 17:15
- 菊地亜美がまっちゃんねる「女子メンタル」で優勝!2代目王者に輝く!06/20 16:15
- ビール100円!お酒再開を記念して、大阪梅田/中崎町「バルバラマーケットプレイス中崎本店」で6月21日(月)~25日(金)06/20 16:15
- 新規Vtuber事務所「ハコネクト」1期生がついにデビュー! さらに2期生のSHOWROOMオーディションエントリーも開始!06/20 16:15
- 最新のプレスリリースをもっと見る
