関連記事
DNAの変換ルールを改変することで、多様なアミノ酸を高効率でタンパク質に導入―理研

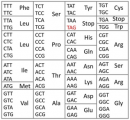
遺伝暗号によるDNAの塩基配列からタンパク質のアミノ酸配列への変換を示す図。DNAの塩基配列の情報を遺伝暗号に従って変換するとタンパク質中のアミノ酸配列が得られる。塩基にはA、G、C、Tの4種類があり、アミノ酸には、メチオニン(Met)やアラニン(Ala)など20種類が存在する。遺伝子末端の「TAG」はタンパク質合成の終了を意味する終止コドンである。(理化学研究所の発表資料より)[写真拡大]
理化学研究所の坂本健作チームリーダーらの研究チームは、大腸菌の遺伝暗号を改変することで、多様なアミノ酸をタンパク質に高い効率で導入できる技術を開発した。
ヒトのタンパク質を構成している20種類のアミノ酸は「遺伝暗号」によって決められており、大腸菌からヒトまでのほとんどの生物で同じである。そのため、医薬品や産業用酵素などのタンパク質の多くは、組換えDNA技術を用いて大腸菌で生産することができている。しかし、20種類のアミノ酸以外の有用な新規アミノ酸を含んだ組換えタンパク質の生産技術は開発途上であり、実用できる生産量の実現にまで至っていなかった。
今回の研究では、大腸菌のゲノムを改変することで、遺伝暗号の中でタンパク質の合成の終了を意味する「終止コドン」の1つ「TAGコドン」を何の意味も持たないコドンに変えた大腸菌株を作成した。この大腸菌株を利用すると、TAGコドンを使って新規アミノ酸をタンパク質に導入できる。
この大腸菌株を用いて、血液凝固を防ぐ薬として使われているタンパク質「ヒルジン」への硫酸化アミノ酸の取り込みを劇的に改善することに成功した。ヒルジンは血液凝固を防ぐ薬として使われており、硫酸化アミノ酸を取り込むことで効果が増強されることが知られているが、これまでは実験レベルにとどまっていた。また、抗体を活用した医薬品は、これからの医薬品としてますます有望視されているが、その抗体にも自由に新規アミノ酸を導入して機能を高度化できる可能性を示した。
今後は、本研究で開発した大腸菌株が、機能を高度化したタンパク質医薬品や産業用酵素の大量生産に繋がることが期待される。
なお、この内容は「Scientific Reports」に掲載された。論文タイトルは、「Highly reproductive Escherichia coli cells with no specific assignment for the UAG codon」。
スポンサードリンク
スポンサードリンク
- ヒッグス粒子の存在を予言したピーター・ヒッグス博士が死去 4/10 18:21
- 黒鉛が生命誕生のカギだった可能性 ケンブリッジ大の研究 4/ 7 17:18
- 老化しにくいハダカデバネズミ、老化細胞を除去する仕組み解明 熊大ら
 7/15 15:19
7/15 15:19 - 人類の祖先は恐竜と共存し、恐竜絶滅を生き延びたか 英ブリストル大学らの研究
 6/29 16:13
6/29 16:13 - 北海道で発見された紫外線で光る新鉱物、「北海道石」として認定 5/30 11:52